ln-situ
Fixierung von Schadstoffen in der Uranerzgrube Königstein der Wismut GmbH durch
eine gesteuerte BaSO4 Kristallisation
Gerald Ziegenbalg1, Jochen Schreyer2
1) Bergakademie Freiberg, Institut für
Technische Chemie, Leipziger Strasse 29,
09596 Freiberg
2)
Wismut GmbH, Jagdschänkenstrasse 29, 09034 Chemnitz
1. Einleitung
Seit
Beendigung des Uranabbaues im Jahre 1990 laufen vielfältige Arbeiten und Untersuchungen
zur sicheren Verwahrung der Grube Königstein der Wismut GmbH. Im Mittelpunkt
steht dabei die Realisierung eines gesteuerten Flutungsprozesses. Um eine Gefährdung der
Grundwasserleiter zu vermeiden, werden die schadstoffhaltigen Flutungswässer in
einer speziell aufgefahrenen Kontrollstrecke erfasst und anschließend übertägig
aufbereitet. Neben der Möglichkeit Schadstoffe vor der Flutung durch einen
Waschprozess zu entfernen, ist insbesondere der Einsatz von in-situ
Immobilisierungsverfahren zur Reduzierung des Schadstoffanfalls von Interesse.
Eine Fixierung
von Schadstoffen erfordert dabei, sowohl die in anwesenden Porenwässern gelöst
vorliegenden Schwermetalle zu binden als auch sekundäre Laugungsprozesse bei
einem Zutritt von Wasser zu verhindern. Bisher bekannte Verfahren zur in-situ Immobilisierung von Schwermetallen
können auf Grund der Spezifik der Lagerstätte sowie der angewandten
Gewinnungstechnologie nicht genutzt werden. So ist der Einsatz von Lösungen,
die bei einem Vermischungsprozess mit Porenlösungen zur Ausfällung von
schwerlöslichen Verbindungen führen problematisch. Eine gesteuerte Vermischung
von zwei Lösungen ist in einem porösen Gestein nur schwer zu realisieren. Es
kommt oftmals nur zu Mischungsprozessen in den Randzonen zwischen beiden
Lösungen. Im Falle des Ablaufens von Fällprozessen werden diese sehr schnell
erfolgen und im ungünstigsten Fall zu einem Verschluss der Aufgabebohrungen
führen, d.h. es können nur sehr geringe Reichweiten erzielt werden.
Möglichkeiten einer zeitlichen Steuerung des Fällprozesses sind nicht gegeben.
Aufbauend
auf langjährigen Untersuchungen zu Kristallisationsprozessen aus übersättigten
Lösungen konnte ein neuartiges Verfahren zur in-situ Schadstoffimmobilisierung entwickelt werden, welches auf
dem Einsatz von BaSO4 bildenden Lösungen beruht. Dieses ermöglicht sowohl
eine Fixierung gelöster Schadstoffe als auch eine Immobilisierung von
reaktiven Mineraloberflächen. Der nachfolgende Artikel gibt einen Überblick
über die Grundlagen des Verfahrens und fasst den Weg von Labor- und Technikumsuntersuchungen
über Feldtests bis hin zur Anwendung zur Sanierung ausgewählter Bereiche zusammen.
2. Grundlagen
der entwickelten Technologie
Die Herstellung von Lösungen die zu einer zeitlich steuerbaren BaSO4
Kristallisation führen ist auf drei Wegen möglich:
1. Vermischung von BaCl2 und Na2SO4-haltigen
Lösungen,
2. Neutralisation von Ba(OH)2- Lösungen mit verdünnter
Schwefelsäure,
3. Vermischung von Ba(OH)2-Lösungen mit Na2SO3-haltigen
Lösungen.
Wesentlich ist dabei, dass der Vermischungsprozess in
Gegenwart eines Fällungsverzögerers durchgeführt wird, andernfalls erfolgt eine
spontane, quantitative Ausfällung ohne, dass Möglichkeiten einer zeitlichen
Kontrolle gegeben sind. Bereits Inhibitorgehalte von 1 mg/l ermöglichen die
Stabilisierung eines BaSO4-Gehaltes von 45 mg/l über einen Zeitraum
von mehreren Tagen (Bild 1). Eine elegante Möglichkeit, reine BaSO4-Lösungen
zu synthetisieren, ist durch die Vermischung von Ba(OH)2-Lösungen
mit verdünnter Schwefelsäure gegeben. Der Inhibitorzusatz verhindert eine
spontane Fällung und es können langzeitstabile Übersättigungen aufgebaut
werden. Bild 2 zeigt den Verlauf der BaSO4-Fällung bei einer
Inhibitorkonzentration von 100 mg/l. Während Ba2+-Konzentrationen
von 100 mg/l über einen sehr langen Zeitraum stabil in Lösung gehalten werden,
weisen 200 mg/l Ba2+ enthaltende Lösungen nur eine zeitlich
begrenzte Stabilität auf. Eine Ba2+-Konzentration von 100 mg/l
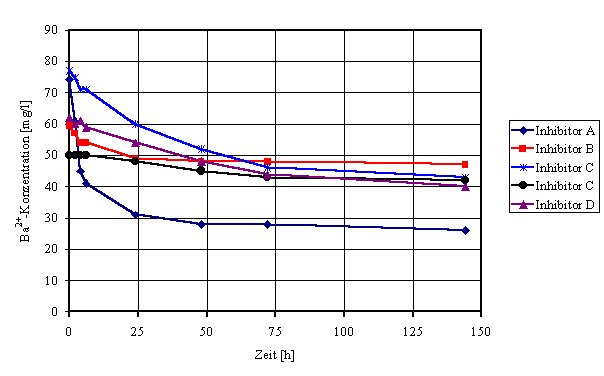
Bild 1: Verlauf der BaSO4-Fällung
aus übersättigten Lösungen in Gegenwart von unterschiedlichen Inhibitoren bei
einer Inhibitorkonzentration von 1 mg/l
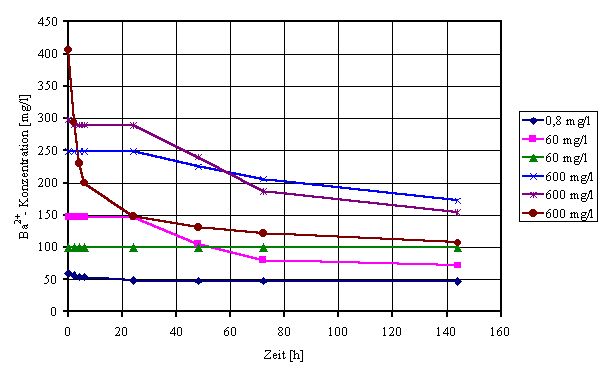
Bild 2: Verlauf der BaSO4-Fällung
in Abhängigkeit von der Inhibitorkonzentration.
entspricht dabei etwa dem 70-fachen der
Gleichgewichtskonzentration. Der Übersättigungsabbau wird durch folgende
Prozesse beeinflusst:
·
Zersetzung des
Fällungsverzögerers (z.B. durch Hydrolyse) und damit Aufhebung von dessen
Wirkung,
·
Adsorption des
Fällungsverzögeres an Gesteinsoberflächen,
·
Ausfällung des
Inhibitors bei einem Kontakt mit anstehenden Poren- oder Kluftwässern
Bei einem Einsatz von Na2SO3 als
sulfatbildender Komponente weisen die resultierenden Lösungen einen
reduzierenden Charakter auf, gleichzeitig sind sie alkalisch. Die Stabilität
der Lösung wird wiederum durch die Inhibitorkonzentration bestimmt. Zur
Erhöhung der Immobilisierungskapazität können geringe Anteile an verdünnter Wasserglaslösung
zugesetzt werden. Es resultiert eine Aufgabelösung, die bei gleichen
Inhibitorkonzentrationen eine höhere Stabilität aufweist als vergleichbare,
unter Einsatz von verdünnter Schwefelsäure hergestellte, Lösungen.
Die Zusammensetzung der BaSO4-bildenden Lösungen kann in
weiten Bereichen variieren. Damit ist es möglich, diese an die jeweils zu
lösende Aufgabestellung gezielt anzupassen.
3. Ergebnisse
von Technikumsversuchen
Zur Untersuchung der erzielbaren Schadstofffixierung sowie zur
Bestimmung der Stabilität der gebildeten Fällprodukte wurden eine Vielzahl von
Durchströmungsversuchen sowohl an kompaktem Sandstein als auch an gelaugten und
ungelaugtem Haufwerk durchgeführt. Die für die Untersuchungen an kompaktem
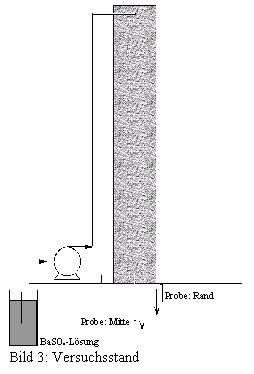
Sandstein aufgebaute Versuchsapparatur ist in den Bilder 3 und 4 dargestellt.
Es sind Sandsteinsäulen mit einem Durchmesser von 30 cm und einer Länge von 2
m, welche aus plan geschnittenen Bohrkernen zusammengesetzt wurden. Die
Bohrkerne stammten aus einem ehemaligen Laugungsblock in der Grube Königstein.
Die Abdichtung erfolgte durch ein Versiegeln der Oberfläche mit Latex sowie
einer abschließenden Beschichtung mit Gebinden aus Kaltteer, die durch eine Heißluftbehandlung
verschmolzen wurden. Die Säule wurde von oben nach unten mit einer 170 mg/l BaSO4
enthaltenden Lösung beaufschlagt. Der mittlere Volumenstrom betrug 8 l/d, der
Aufgabedruck lag bei 0,3 bar. Nach Beendigung der Aufgabe BaSO4-übersättigten
Lösung begann die über einen Zeitraum von 19 Tagen erfolgende Aufgabe von 106,5
l Wasser. Danach wurde für einen Zeitraum von 7 Tagen der Lösungsaustritt unterbunden und es erfolgte im Anschluss eine
erneute Aufgabe von 60 l Wasser.
 Zur
Herstellung der Injektionslösung wurde natürliches Grundwasser der Grube
Königstein mit einem pH-Wert von 6,78 und einer Leitfähigkeit von 0,196 mS/cm
eingesetzt. Dieses wurde auch in den anschließenden Waschprozessen genutzt. Die
Herstellung der BaSO4-übersättigten Lösungen erfolgte diskontinuierlich,
wobei als lösliche Ba2+-Komponente Ba(OH)2*8H2O
zum Einsatz kam. Nach einem Auflösen wurde die resultierende Ba(OH)2-Lösung
unter intensivem Vermischen dem Drainagewasser zugesetzt. Dieses enthielt den
Inhibitor in einer Konzentration von 100 mg/l. Die Einstellung des pH-
Zur
Herstellung der Injektionslösung wurde natürliches Grundwasser der Grube
Königstein mit einem pH-Wert von 6,78 und einer Leitfähigkeit von 0,196 mS/cm
eingesetzt. Dieses wurde auch in den anschließenden Waschprozessen genutzt. Die
Herstellung der BaSO4-übersättigten Lösungen erfolgte diskontinuierlich,
wobei als lösliche Ba2+-Komponente Ba(OH)2*8H2O
zum Einsatz kam. Nach einem Auflösen wurde die resultierende Ba(OH)2-Lösung
unter intensivem Vermischen dem Drainagewasser zugesetzt. Dieses enthielt den
Inhibitor in einer Konzentration von 100 mg/l. Die Einstellung des pH-
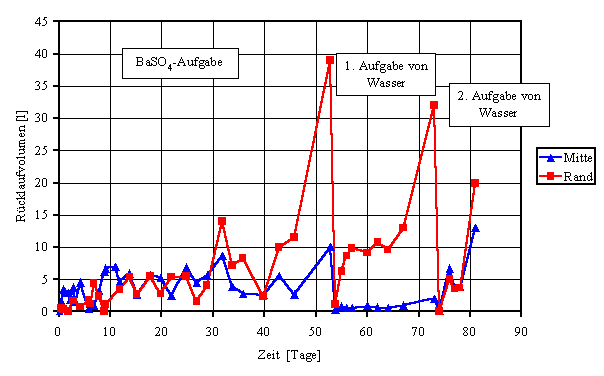
Bild 5: An den beiden Messpunkten erfasste
Rücklaufvolumen
Wertes erfolgte mit 0,01 N H2SO4.
Über einen Versuchszeitraum von 54 Tagen erfolgte die Aufgabe von insgesamt 300
l übersättigter Lösung. Es wurden 278 l Rücklauflösung erhalten, welche in der
Mitte der Säule sowie als Sammelprobe am unteren Rand erfasst wurde. Bei einem
Volumen der Sandsteinsäule von ca. 141 l und einer Volumenporosität von 19%
entsprach dies bei einem Anteil an freien Poren von 63% einem 16fachen
Austausch des Porenvolumens. Insgesamt wurden 51 g BaSO4 in die
Säule eingebracht.
Zu Versuchsbeginn traten die Lösungen überwiegend aus
der Mitte der Säule aus, es wurden nur geringe Lösungsmengen aus den
Randbereichen erfasst. Mit zunehmender Versuchsdauer nahmen jedoch die aus der
Mitte austretenden Lösungsvolumina ab während die aus den Randbereichen austretenden
Lösungsmengen anstiegen. Dieser Effekt ist auf eine Permeabilitätsverringerung
in den von der BaSO4-übersättigten Lösung durchflossenen Bereichen
zurückzuführen. Die Lösung nahm zu Versuchsbeginn den kürzesten Weg zwischen
Aufgabe- und Austrittstelle. Mit zunehmender Versuchsdauer bewirkte die in der
Säule ablaufende BaSO4-Kristallisation einen zumindest teilweisen Verschluss
der Hauptfließwege, so dass sich die Lösung zunehmend auf die Randbereiche
verteilte und diese durchströmte. In den sich an die BaSO4-Aufgabe
anschließenden Waschprozessen kam es zu keinen Veränderungen in den
Strömungsverhältnissen, das aufgegebene Wasser verteilte sich im Sandsteinblock
und trat bevorzugt an den Randbereichen aus (Bild 5 ). Die Ergebnisse zeigen,
dass die eingebrachten 51 g BaSO4, die bei einer Dichte von 4,5 g/cm3
lediglich ein Volumen von 11,3 ml einnehmen, zu einer Permeabilitätsverringerung
führen, die nicht durch ein großflächiges Verfüllen von Fließwegen zu erklären
ist. Es erfolgt ein Verschluss der Fließwege durch eine Kristallisation an bevorzugt
durchströmten Bereichen, die dann Zuwachsen und somit zu einer Verringerung
oder Unterbindung weiterer Strömungsvorgänge führen.
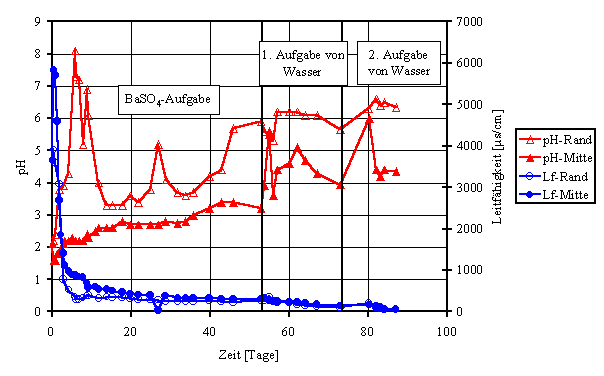
Der
Verlauf der Leitfähigkeit sowie des pH-Wertes der während der BaSO4-Aufgabe
ausdrainierenden Lösungen ist in Bild 6 dargestellt. Der schnelle Anstieg der
Leitfähigkeit weist auf ein Verdrängen von Porenlösungen sowie auf die
anfängliche Auflösung von leicht löslichen Sekundärmineralen hin. Es entstehen
Lösungen mit einem pH-Wert zwischen 1,6 und 2,2. Bereits nach dem Ausdrainieren
eines dem Porenvolumen entsprechenden Lösungsvolumens verdeutlicht die stark
gesunkene Leitfähigkeit das Austreten von Lösungen mit einem erheblich
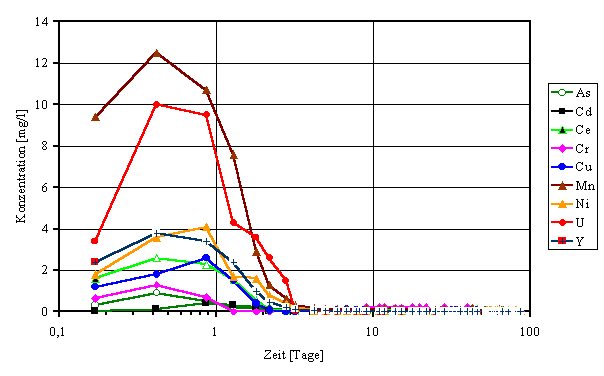
reduzierten Schadstoffgehalt. Dabei ist der prinzipielle Konzentrationsverlauf
in den Lösungen von beiden Probenahmestellen gleich. Mit zunehmender Aufgabe an
BaSO4-Lösung kommt es zu schnell abfallenden Schadstoffkonzentrationen
(Bild 7). Nach dem Durchsatz des zweifachen Porenvolumens weisen die Lösungen,
trotz eines pH-Wertes von
Bild
6: Verlauf der Leitfähigkeit und des pH-Wertes an den beiden Messstellen
Bild
7: Schadstoffverlauf in den austretenden Lösungen (Messstelle: Mitte)
2,2,
Konzentrationen auf, die nur geringfügig über denen des eingesetzten
Grundwassers liegen (vgl. Tab. 1). Die pH-Werte der in den Randbereichen
erfassten Lösungen steigen schneller an, unterliegen jedoch auch stärkeren
Schwankungen als in den aus dem Mittelbereich austretenden Lösungen. Ansteigende
pH-Werte verdeutlichen, in Verbindung mit dem kurzfristigen Austreten von Ba2+-haltigen
Lösungen, die schrittweise Ausbildung von immobilisierten Bereichen. Wieder abfallende
pH-Werte zeigen das Vordringen der Lösung in bisher unbeeinflusste Bereiche.
Dies wird durch das Ablaufen von Kristallisationsprozessen möglich, die zu
einem Verschluss von Fließwegen führten und somit eine Veränderung der
Strömungsverhältnisse bewirkten.
Tab. 1: Schadstoffgehalte
der nach dem Durchsatz von einem Porenvolumen austretenden Lösungen im
Vergleich zum eingesetzten Wasser:
|
|
zur
Lösungsherstellung genutztes Grundwasser |
Zusammensetzung
nach Durchsatz eines Porenvolumens |
|
zur
Lösungsherstellung genutztes Grundwasser |
Zusammensetzung
nach Durchsatz eines Porenvolumens |
|
Zeit
/d/ |
0 |
3,2 |
Cr[mg/l] |
0 |
0 |
|
erfasstes
Volumen |
- |
21,1 |
Cu[mg/l] |
0 |
0 |
|
TDS [g/l] |
0,11 |
0,44 |
Fe[mg/l] |
0 |
4,5 |
|
pH |
6,78 |
2,2 |
Mg[mg/l] |
22 |
4,3 |
|
Lf [µs/cm] |
196 |
1124 |
Mn[mg/l] |
0,1 |
0,31 |
|
Cl [mg/l] |
17,9 |
34 |
Mo[mg/l] |
0 |
0 |
|
SO42- [mg/l] |
55,9 |
277 |
Na[mg/l] |
6,6 |
41 |
|
Al[mg/l] |
0,02 |
5,5 |
Ni[mg/l] |
0 |
0,2 |
|
As[mg/l] |
0,02 |
0,05 |
Pb[mg/l] |
0 |
5,1 |
|
Ba[mg/l] |
0,11 |
0,03 |
Sr[mg/l] |
0,03 |
1,7 |
|
Ca[mg/l] |
29 |
42,3 |
U[mg/l] |
0 |
0,05 |
|
Cd[mg/l] |
0 |
0 |
Y[mg/l] |
0 |
0,12 |
|
Ce[mg/l] |
0 |
0 |
Zn[mg/l] |
0 |
1,8 |
|
Co[mg/l] |
0 |
1,6 |
Zr[mg/l] |
0,01 |
0 |
Die sich anschließenden beiden Etappen der Aufgabe von Wasser führten
zu keinem erneuten Freisetzen von Schadstoffen. Es kann somit davon ausgegangen
werden, dass sowohl eine Unterbindung von neuen Löseprozessen als auch eine
Fixierung von gelösten Schadstoffen erzielt wurde. Neben der Kristallisation
von BaSO4 sollten auch Hydroxidfällungen sowie Adsorptionsprozesse
zu dieser drastischen Reduzierung der Schadstoffgehalte der austretenden
Lösungen geführt haben.
4. Ergebnisse
von Feldtests
Zur Untersetzung und Überprüfung der Labor- und
Technikumsuntersuchungen wurden umfangreiche Feldtests sowohl im
Quadersandstein als auch in magazinierten Bereichen der Grube Königstein durchgeführt.
Die Untersuchungen zur Schadstoffimmobilisierung in gelaugtem Quadersandstein
sind in den Bildern 8-11 zusammengefasst. Die BaSO4-Lösung wurde
durch eine kontinuierliche Vermischung von Ba(OH)2-Lösung,
Inhibitorkonzentrat und verdünnter H2SO4 hergestellt und
simultan über 6 Bohrlöcher im ersten Erzhorizont in das Gestein eingebracht
(Bild 8). Nach dem Passieren des Blockabschnittes erfolgte im 2. Erzhorizont
die Erfassung der Rücklauflösungen über Drainagebohrungen bzw. als Stoßdrainage.
Über einen Zeitraum von 8 Wochen erfolgte die Aufgabe von ca. 5.200 m3
BaSO4-übersättigter Lösung mit einem mittleren Gehalt von 200 mg/l.
Der Schadstoffverlauf in den unmittelbar unter den Aufgabebohrungen erfassten
Rücklauflösungen ist in den Bild 9 und 10 dargestellt. Die ersten Lösungen
resultieren aus dem Durchströmen von bevorzugten, sehr wasserwegsamen Fließwegen.
Die in diesen befindlichen Porenlösungen wurden sehr schnell durch die BaSO4-übersättigte
Lösung neutralisiert und ein Großteil der Schadstoffe wurde durch Fällung aus
diesen entfernt. Es traten Lösungen mit geringen Schadstoffgehalten auf. Mit zunehmender
Wassersättigung wurden auch geringer permeable Bereiche, die einen hohen Anteil
an stark sauren Porenwässern enthielten, in den Stoff- und Lösungstransport
einbezogen. Es kam zum Austritt von Lösungen mit hohen
Schadstoffkonzentrationen. Das sehr schnelle Durchlaufen eines Maximums
verdeutlicht das Vordringen der BaSO4-Lösung. Es folgen Lösungen mit
nur noch geringen, kontinuierlich abnehmenden Konzentrationen. Dieser Verlauf
war für alle erfassten Rücklauflösungen charakteristisch, wobei jedoch der
Effekt der BaSO4-Lösung mit zunehmendem Abstand zur Aufgabestelle
erwartungsgemäß geringer wurde. Wesentlich ist, dass der Abfall der
Schadstoffkonzentrationen nicht nur auf die aus den Drainagebohrungen
austretenden Rücklauflösungen beschränkt war, sondern auch die aus dem Stoßbereich
austretenden einschloss. Der beaufschlagte Sandsteinblock wurde somit homogen
von der BaSO4-Lösung durchflossen und es kam zu einer großflächigen
Schadstoffimmobilisierung.
Bild 8:
Schematische Darstellung des Aufgabeprozesses
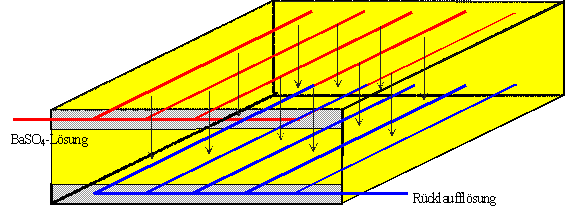

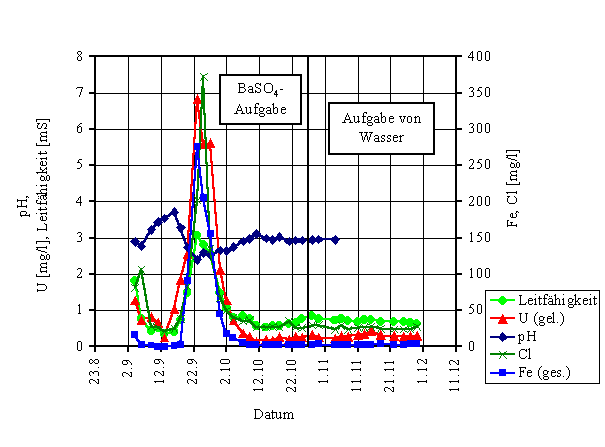
Bild 9: Konzentrationsverlauf in der direkt unter der Aufgabestelle
erfassten Rücklauflösung BL-28
Bild 11 zeigt den Verlauf der Uranfrachten für drei direkt unter der
Aufgabestelle liegende Rücklaufbohrungen. In Analogie zum Verlauf der
Absolutkonzentrationen wird sehr schnell ein Maximum durchlaufen und es kommt,
trotz zunehmender Absolutmengen an Rücklauflösung, zu einem deutlichen Rückgang
der ausgetragenen Uranmengen. Neben der Immobilisierung von löslichen sowie gelösten
Schadstoffen führte der Einsatz von BaSO4-übersättigten Lösungen
wiederum zu einer signifikanten Veränderung der Strömungsverhältnisse im
beaufschlagten Blockabschnitt. Durch eine Blockierung von Fließwegen durch BaSO4-Kristallisate
sowie sekundär gebildete Fällprodukte (insbesondere Eisen- und Aluminiumhydroxide)
wurden gering permeable Bereiche in einen Stoff- und Lösungstransport
einbezogen, die bei einem Waschprozess nur aufgefüllt worden wären. Dies führte
zu einer hohen Schadstoffabreicherung und war insbesondere in einer
kontinuierlichen Verbreiterung der Rücklauf-
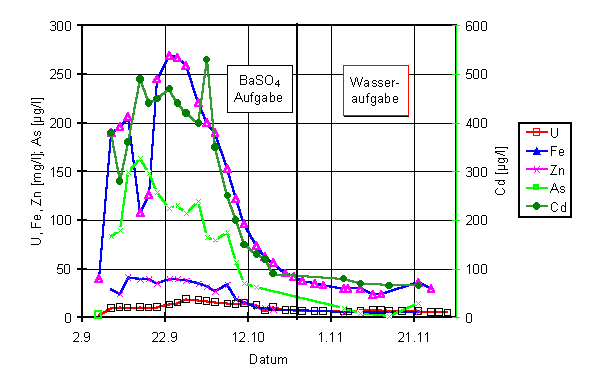
Bild 10: Konzentrationsverlauf in der direkt unter der Aufgabestelle
erfassten Rücklauflösung BL-29
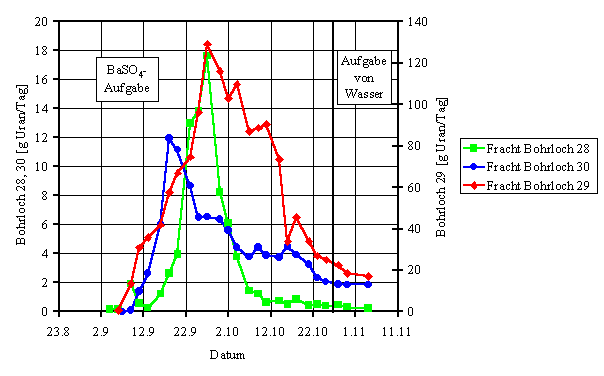
Bild 11: Verlauf des Uranaustrages in den Bohrlöchern 28-30
fläche sichtbar. Während die Intensität der zentral gelegenen Rückläufe
abnahm erfolgte ein kontinuierlicher Anstieg der Rückläufe aus den Randbereichen.
Nach Beendigung der Aufgabe der BaSO4-übersättigten Lösung
wurde der Blockabschnitt mit Wasser beaufschlagt. Die dabei konstant niedrig
bleibenden Schadstoffkonzentrationen verdeutlichen in Verbindung mit den
unterhalb des Löslichkeitsproduktes liegenden Ba2+-Gehalten die
Beständigkeit so-
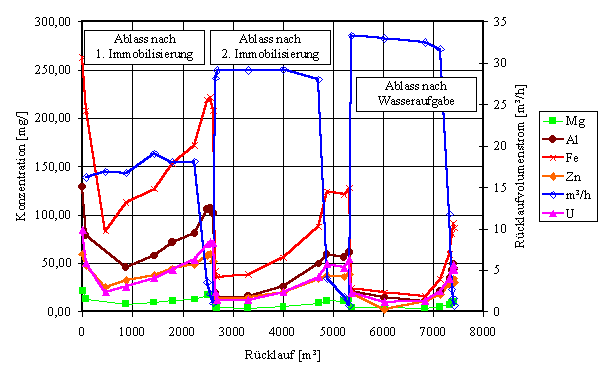
Bild 12: Konzentrationsverlauf beim Ablassen eines mit einer Ba(OH)2-Na2SO3-Wasserglas-Inhibitor-
Lösung gefüllten Magazins
wohl der erreichten Permeabilitätsverringerung als
auch der Schadstofffixierung. Nachlaugeerscheinungen traten ebenso wie ein
Freispülen von abgedichteten Bereichen nicht auf.
Aufgrund des hohen mobilen und mobilisierbaren Schadstoffpotenzials war
es besonders wichtig, für die magazinierten Bereiche der Lagerstätte Königstein
eine geeignete, im Vorfeld einer Flutung einsetzbare Sanierungstechnologie zu
entwickeln. In magazinierten Bereichen liegt der uranhaltige Sandstein in
abgeschlossenen Kammern als gesprengtes Haufwerk vor. Sowohl gelaugte als auch
ungelaugte Magazine werden bei einem Flutungsprozess zu sauren, hoch
kontaminierten Lösungen führen. Die Ergebnisse von Feldversuchen in denen ein
magazinierter Bereich zweimal mit einer BaSO4 bildenden Lösung sowie
im Anschluss mit Wasser aufgefüllt wurde, sind in Bild 12 zusammengefasst.
Aufgetragen sind die in den Ablasslösungen auftretenden
Schadstoffkonzentrationen. Es ist ein von Etappe zu Etappe abnehmender
Schadstoffaustrag zu verzeichnen, der auf eine Fixierung durch die eingesetzte
Ba(OH)2-Na2SO3-Inhibitor-Wasserglas-Lösung
zurückzuführen ist. Der anschließende Waschprozess führt zu keinen
Auflöseprozessen, im Gegenteil, es ist ein weiterer Rückgang der
Schadstoffmengen zu verzeichnen. Durch den Einsatz von BaSO4
bildenden Lösungen konnten -im Vergleich zu einem Waschprozess mit Wasser-
zwischen 50 und 65% der freisetzbaren Schadstoffe fixiert werden (Tab. 2).
Tab.2: Beim Entleeren eines zweimal mit einer Ba(OH)2-Na2SO3-Inhibitor-Wasserglas
gefüllten Magazins auftretende Schadstoffausträge im Vergleich mit den bei
einem Waschprozess mit Wasser zu erwartenden
|
|
Al [kg] |
Fe [kg] |
Sulfat [kg] |
Uran [kg] |
Zn [kg] |
As [kg] |
|
1.
Immobilisierung |
153 |
363 |
2975 |
11,6 |
102 |
0,14 |
|
Theoretisch bei
Waschen |
389 |
794 |
5801 |
29,8 |
161 |
0,38 |
|
2.
Immobilisierung |
89 |
183 |
1981 |
8,1 |
52 |
0,0 |
|
Theoretisch bei
Waschen |
218 |
427 |
4350 |
18,56 |
151 |
0,35 |
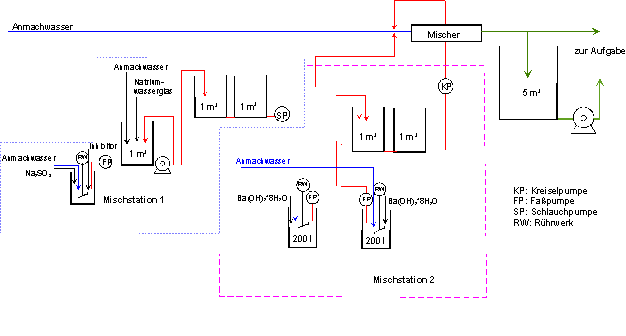
Bild 13: Aufbau der Anlage zur Schadstoffimmobilisierung in
magazinierten Bereichen der Grube Königstein
Wie elektronenmikroskopische Untersuchungen an Proben aus
Laboruntersuchungen zeigten, führt der Einsatz von Ba(OH)2-Na2SO3-Inhibitor-Wasserglas
Lösungen zur Überschichtung der Quarzkörner mit kleinen, unregelmäßigen
Barytkristallen. Gleichzeitig ist die Bildung von nicht näher identifizierbaren,
O, Na, Al, Si, Ba und Fe enthaltenden Sekundärmineralen nachweisbar. Es ist
somit möglich, sowohl reaktive Gesteinsoberflächen gezielt zu immobilisieren
als auch lösliche Schadstoffe langzeitbeständig zu fixieren. Dabei ist
insbesondere die Bildung von Eisen- und Aluminiumhydroxiden bzw.
-hydroxysulfaten wesentlich. Diese können während des Fällprozesses eine Vielzahl
von Ionen einschließen. Gleichzeitig wirken sie als Adsorbentien für
Schwermetalle.
5. Großtechnische
Anwendung des Verfahrens
Aufbauend auf den positiven Ergebnissen der Feldversuche wurde im
November 2001 entschieden, das Verfahren zur Schadstofffixierung im Südfeld der
Lagerstätte einzusetzen. In diesem wurden große Bereiche magaziniert, durch die
Beendigung des Uranabbaus jedoch nicht mehr gelaugt. Aufgrund eines seit über 10
Jahren möglichen Luft- und Feuchtigkeitskontaktes wird eine Flutung dieses Bereiches
zu sauren Lösungen mit hohen Schadstoffkonzentrationen führen. Mit der
Anwendung von BaSO4-bildenden Lösungen sollte der zu erwartende
Schadstoffaustrag reduziert werden. Im Zeitraum von Dezember 2001 bis Juni 2002
wurden ca. 100.000 m3 einer Ba(OH)2-Na2SO3-Wasserglas-Fällungsverzögerer
enthaltenden Lösung in 3 Magazine eingebracht. Dazu wurde eine untertägige
Mischstation aufgebaut, die aus den Modulen
·
Mischstation zur
Herstellung einer Inhibitor-Na2SO3-Wasserglas-Lösung
·
Lösestation für
Ba(OH)2*8H2O zur Herstellung der Ba(OH)2-Lösung,
·
kontinuierliche
Vermischung der Inhibitor-Na2SO3-Wasserglas-Lösung sowie
der Ba(OH)2-
Lösung mit einem Hauptwasserstrom und kontrollierte Aufgabe.
bestand. Das Schema der Anlage ist in
Bild 13 dargestellt, Details zeigen die Bilder 14 und 15. Die Lösung wurde über
ein Rohrleitungssystem den aufzufüllenden Bereichen zugeführt und floss über entsprechende
Bohrungen frei in die Magazine aus. Der Aufgabevolumenstrom lag zwischen 30 und
50 m³/h. Nach einer Einweisung und einer anfänglichen Anlernphase konnte
die Anlage problemlos vom Personal der Grube betrieben werden. Der Erfolg der
Immobilisierung wurde durch Analysen von Ablasslösungen bestätigt.

Bild 14: Anlage zur
Herstellung der Immobilisierungslösung

Bild 15. Mischstation zur Herstellung der Ba(OH)2-Lösung
6. Zusammenfassung
Die Anwendung von gesteuerten Kristallisationsprozessen aus
übersättigten Lösungen eröffnet eine Vielzahl von Möglichkeiten zur
Schadstofffixierung in porösen oder klüftigen Gesteinsformationen. Hinsichtlich
einer langzeitbeständigen Immobilisierung ist insbesondere der Einsatz von BaSO4
bildenden Lösungen von Interesse. Diese können sowohl in Form von „reinen“ BaSO4-Lösungen,
die durch ein Vermischen von Ba(OH)2-Lösungen und verdünnter
Schwefelsäure in Gegenwart eines geeigneten Fällungsverzögerers herstellbar
sind oder in Form von Ba(OH)2-Na2SO3-Wasserglas-Fällungsverzögerer
enthaltenden Lösungen eingesetzt werden. Erstere Lösungen führen zu einer Passivierung
von reaktiven Mineraloberflächen durch die Ausbildung von BaSO4-Schichten
sowie zu einer steuerbaren Veränderung der Strömungsverhältnisse in den
behandelten Bereichen. Das dabei erfolgende Blockieren von Fließwegen führt dazu, dass auch gering
permeable Gesteinsbereiche in den Stoff- und Lösungstransport einbezogen
werden. Lösungen
auf der Basis von Ba(OH)2 und Na2SO3 besitzen
ein höheres Immobilisierungspotenzial, welches wiederum zur Ausbildung von
schützenden Schichten auf löslichen Mineraloberflächen führt, jedoch
gleichzeitig eine Fixierung von
gelösten Schwermetallen in Form von schwerlöslichen Verbindungen ermöglicht. In
Abhängigkeit von den Erfordernissen könne sehr unterschiedliche BaSO4-bildende
Lösungen zusammengesetzt werden, die eine auf die jeweilige Anwendungssituation
abgestimmte Stabilität aufweisen.